La physique quantique 1
ou
Lumière sur le photon
La physique quantique 1
ou
Lumière sur le photon
![]() Introduction
Introduction
La théorie quantique est utilisée par les physiciens pour rendre compte des phénomènes qui ont cours à l'échelle microscopique des particules.
 La
puissance oprératoire de cette physique est considérable.
Elle est désormais utilisée par les physiciens nucléaires
et atomistes, par les physiciens du solide et même par les astrophysiciens.
A ce jour, aucune expérience n'est venue démentir ses prédictions,
aussi étranges soient-elles. La physique quantique utilisant des
concepts qui n'ont pas toujours de contrepartie dans la vie courante, il
ne faut pas s'étonner si certaines de ses prédictions heurtent
si violemment le sens commun.
La
puissance oprératoire de cette physique est considérable.
Elle est désormais utilisée par les physiciens nucléaires
et atomistes, par les physiciens du solide et même par les astrophysiciens.
A ce jour, aucune expérience n'est venue démentir ses prédictions,
aussi étranges soient-elles. La physique quantique utilisant des
concepts qui n'ont pas toujours de contrepartie dans la vie courante, il
ne faut pas s'étonner si certaines de ses prédictions heurtent
si violemment le sens commun.
Albert Einstein, pour ne citer que lui, n'a jamais
accepté certaines des conséquences de la théorie quantique:
voyez comme il lui tire la langue!
![]()
![]() Pourquoi
le mot "quantique"?
Pourquoi
le mot "quantique"?
 La
physique quantique signifie littéralement "physique des quanta"
(= pluriel latin de "quantum" qui signifie quantité).
La
physique quantique signifie littéralement "physique des quanta"
(= pluriel latin de "quantum" qui signifie quantité).
Ce nouveau mot apparaît dans le registre de la
physique le 14 Décembre 1900 grâce à un mémoire
révolutionnaire lu devant l'Académie des sciences de Prusse
par l'Allemand Max Planck: Ce dernier postule l'idée originale
selon laquelle les échanges d'énergie entre la lumière
et la matière ne peuvent se faire que par paquets discontinus, que
l'on appellera les quanta. Il renonce ainsi à la loi sacrée
de la continuité, pilier de la physique classique.
![]()
![]() Qu'est
ce que la lumière "classique" et continue ?
Qu'est
ce que la lumière "classique" et continue ?
 Pas
si facile de se représenter un tel concept immatériel!
Pas
si facile de se représenter un tel concept immatériel!
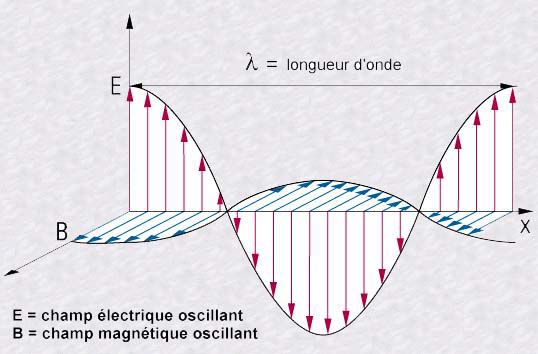
A la fin du XIXe siècle, James Maxwell
définit la lumière comme étant un faisceau d'ondes
électromagnétiques se déplaçant à
vitesse constante dans le vide: la fameuse vitesse c de 300.000
kilomètres par seconde.
Autant il est aisé de s'imaginer une onde parcourant
la surface de l'eau et le son comme étant une vibration de l'air,
autant le concept d'onde électromagnétique (comme étant
une oscillation de champs électrique et magnétique associés)
a de quoi laisser perplexe. Comment imaginer ces champs intimement liés?
quel est le support de cette oscillation dans le vide?
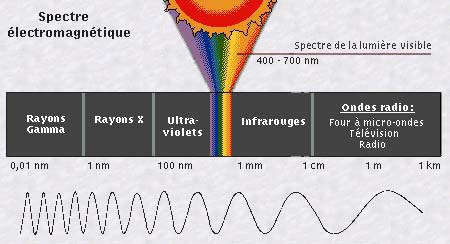
Toujours est-il que la lumière est caractérisée
par sa fréquence (voir plus loin)
ou sa longueur d'onde. La lumière n'est donc qu'une fenêtre
étroite de l'ensemble des ondes électromagnétiques
(qui comprennent aussi les rayons gamma, X, ultraviolets, infrarouges,
les ondes radios...). Voir spectre)
![]()
![]() La
lumière photonique et quantique
La
lumière photonique et quantique
 Après
Max Planck, cette notion radicalement nouvelle de "lumière quantique"
sera reprise en 1905 par Albert Einstein qui soutiendra que l'énergie
de la lumière est en quelque sorte "granuleuse". Ce "grain d'énergie"
sera appelé photon en 1926. Une nouvelle particule est née,
particule immatérielle et sans masse.
Après
Max Planck, cette notion radicalement nouvelle de "lumière quantique"
sera reprise en 1905 par Albert Einstein qui soutiendra que l'énergie
de la lumière est en quelque sorte "granuleuse". Ce "grain d'énergie"
sera appelé photon en 1926. Une nouvelle particule est née,
particule immatérielle et sans masse.
Chaque photon d'un rayonnement (lumière, ondes
radios, rayons X...) est porteur d'un quantum d'énergie caractéristique
de sa fréquence (fréquence de la lumière = couleur).
La physique quantique va donc associer une onde et une
particule. Cette association se généralisera d'ailleurs à
toute particule, et notamment l'électron.
Mais comment concilier du continu (ondes) avec du discontinu
(particules)?
C'est tout le paradoxe de la dualité onde-corpuscule
![]()
![]() La
dualité onde-corpuscule
La
dualité onde-corpuscule
La remise en cause la plus importante à laquelle oblige la physique quantique concerne la manière de représenter les objets physiques et leurs propriétés. L'ancienne physique, dite classique, distingue deux sortes d'entités fondamentales:
La physique quantique ne retient pas cette classification
pourtant bien commode. Les objets qu'elle considère ne sont ni des
corpuscules, ni des ondes, mais "autre chose".
Aidons-nous
de l'analogie suivante:
Regardé sous deux angles différents, un
cylindre nous apparaît tantôt comme un cercle, tantôt
comme un rectangle. Pourtant il n'est ni l'un ni l'autre.
Ainsi en est-il du photon, de l'électron ou de
toute particule élémentaire dont l'image corpusculaire ne
serait qu'une facette d'une entité plus complexe.
Ce point précis peut poser un problème philosophique
très troublant: La réalité objective (s'il elle existe
indépendemment
de l'esprit humain) est-elle accessible ? Ou sommes-nous
condamner à n'observer qu'un monde d'apparences trompeuses?
![]()
![]() D'où
vient la lumière?
D'où
vient la lumière?
La physique quantique permet de mieux comprendre comment
la lumière est émise par la matière...
Le modèle de l'atome de Niels Bohr était
un modèle à la frontière de deux âges: l'âge
classique pré-quantique et le monde quantique. Mais il expliquait
déjà le mécanisme de l'émission de lumière
par un atome
: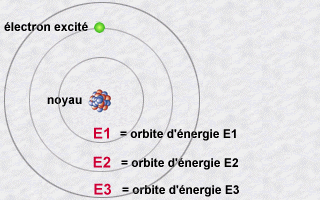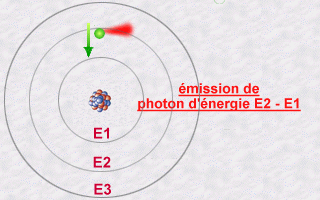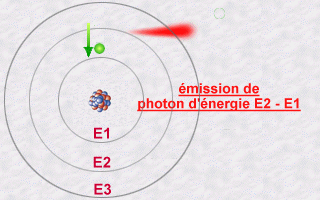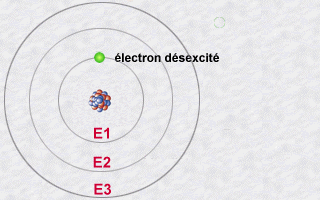
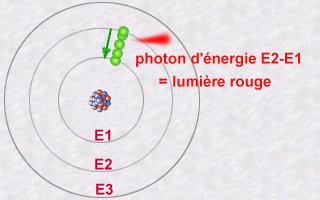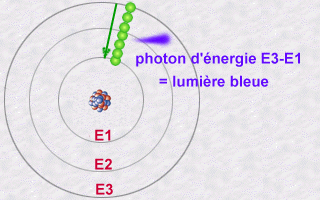
Cette émission s'explique alors par le saut qu'effectue
un électron d'une orbite E2 à une orbite E1. Pendant ce saut
vers l'orbite E1 moins énergétique (une orbite plus intérieure),
l'électron va céder une partie de son énergie sous
forme d'un photon émis vers l'extérieur.
L'énergie de ce photon, E2 - E1, sera un multiple entier (la fameuse quantification de la lumière) de la valeur hn.
Inversement,
l'électron d'un atome pourra absorber un photon d'énergie
donnée en ainsi sauter d'une orbite peu énergétique
à une orbite plus énergétique: Il sera ainsi excité
car sur une orbite plus énergétique que la normale. C'est
en se désexcitant qu'il pourra réémettre un photon.
<------Cliquez sur le dessin
pour l'agrandir!
La
théorie quantique stipule que toutes les orbites électroniques
ne sont pas autorisées. Ces orbites ne sont permises que dans la
mesure où un électron, sautant d'une orbite à une
autre, peut émettre ou absorber un photon d'une énergie multiple
de la fameuse valeur
hn. C'est
cette discontinuité quantique de l'énergie échangée
qui entraîne une discontinuité des orbites permises. Chaque
orbite électronique autorisée sera donc quantifiée
et caractérisée par des nombres quantiques (4 nombres
notés n, l, m et s).
Par exemple, le nombre n s'appelle le nombre quantique
principal. Il désigne le numéro de la couche électronique
aussi désignée par les lettres K, L, M, O, P, Q.
![]()
Chaque atome ne peut donc émettre qu'une palette
précise de couleurs caractéristiques : Chaque couleur de
la lumière est en fait une fréquence particulière
(et donc un niveau d'énergie) de photon. Tous les sauts d'électrons
entre toutes les orbites possibles au sein d'un même atome se traduisent
donc par l'émission (ou l'absorbtion) d'un spectre de lumière
caractéristique: Il s'agit là d'une véritable carte
d'identité d'un type d'atome donné. C'est grâce à
ce spectre facilement identifiable que l'on peut savoir quels atomes existent
dans les étoiles du firmament. Leur lumière est captée
par les télescopes, analysée et comparée avec les
spectres de l'hydrogène, de l'hélium etc...