ou
les électrons rassembleurs d'atomes
![]() Les
électrons et la chimie
Les
électrons et la chimie
L'électron est noté en physique e-.
Normalement, l'atome a autant d'électrons (de charge -) que de protons (de charge +). L'atome est donc globalement neutre au niveau des charges électriques.
De même, un atome de carbone C peut perdre deux électrons et devenir un cation avec deux charges positives excédentaires, il sera noté C2+. Par contre, s'il gagne un électron supplémentaire, il deviendra un anion C-.
![]()
![]()
![]() Liaisons
chimiques
Liaisons
chimiques
Les électrons sont organisés en couches successives autour du noyau selon des règles de remplissage très strictes, et définies par une loi quantique qui sera exposée plus loin (loi d'exclusion de Pauli).
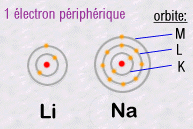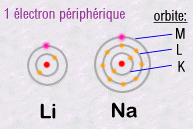 L'important
est de retenir que ce sont les électrons les plus externes
qui sont responsables de toute la chimie, car ce sont eux qui peuvent relier
mutuellement deux atomes distincts en créant des liaisons chimiques.
Par exemple, deux atomes peuvent chacun mettre en commun un de leurs électrons
et ainsi créer ce qu'on appelle une liaison chimique covalente.
Grâce à de telles liaisons, les atomes peuvent s'assembler
en molécules de diversité et de complexité
infinie.
L'important
est de retenir que ce sont les électrons les plus externes
qui sont responsables de toute la chimie, car ce sont eux qui peuvent relier
mutuellement deux atomes distincts en créant des liaisons chimiques.
Par exemple, deux atomes peuvent chacun mettre en commun un de leurs électrons
et ainsi créer ce qu'on appelle une liaison chimique covalente.
Grâce à de telles liaisons, les atomes peuvent s'assembler
en molécules de diversité et de complexité
infinie.
![]()
![]() Molécules
et macromolécules
Molécules
et macromolécules
 Les
molécules sont les assemblages qui sont à la base de la matière
inerte et vivante.
Les
molécules sont les assemblages qui sont à la base de la matière
inerte et vivante.
Dès que le nombre d'atomes d'une molécule
se chiffre par plusieurs centaines, on parle de macromolécules.
Certains polymères peuvent comprendre plusieurs millions d'atomes!
En biochimie (ou chimie de la matière organique),
les molécules, telles les protéïnes, les lipides, les
glucides ou les acides nucléiques (constituants de l'ADN, lui-même
support du code génétique) s'organisent en superstructures
(organites cellulaires); ces dernières sont les constituants
de la cellule vivante, entité de base de tout organisme vivant.
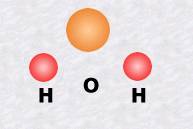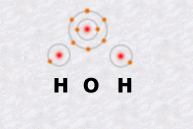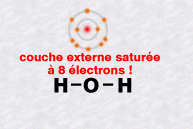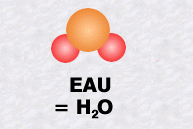
La molécule d'eau, notée H2O, est formée d'un atome d'oxygène et de deux atomes d'hydrogène.
![]()
![]() Comment
s'imaginer l'atome classique?
Comment
s'imaginer l'atome classique?
Imaginez que le noyau de l'hydrogène (un seul proton)
mesure 1 millimètre:
il serait ainsi grossi mille milliards de fois
(grossissement de 1.000.000.000.000 x) !
Le volume du noyau étant un million de milliards
de fois plus petit que celui de l'atome;
|
|
(source: David Calvet du CNRS
Marseille, labo in2p3 un site web de référence sur la
physique nucléaire, d'une très grande clarté).
Depuis peu et indirectement oui, et à l'aide de deux microscopes ultrapuissants:


![]()
|
|
|