La vie en molécules :
buckminsterfullerène ou
footballène ?
footballène C60 :
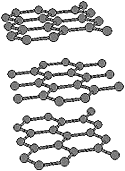
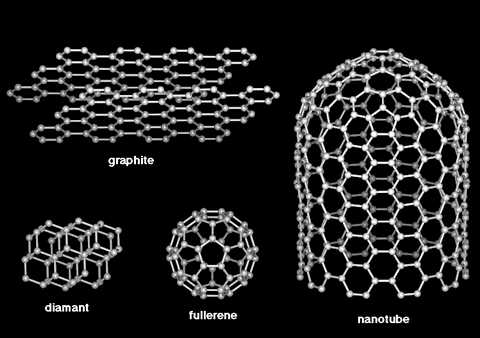
Le carbone est un des éléments chimiques les plus fréquents. Il est à la base de presque toutes les molécules essentielles à la vie, telles que l'ADN, les protéines et les huiles. Le caractère unique du carbone découle de sa capacité à former des liaisons stables avec lui-même. Les autres éléments préfèrent généralement utiliser des partenaires différents pour établir des liaisons chimiques. Cet élément, qui forme plus de composants chimiques avec certains autres éléments (par exemple l'hydrogène, l'oxygène, l'azote) que les quelque 100 éléments réunis, existe essentiellement sous deux formes à l'état pur : le diamant et le graphite. Dans le diamant, chaque atome est lié à quatre autres carbones, formant un réseau tridimensionnel, alors que le graphite est constitué de plans parallèles d'atomes distribués en hexagones réguliers et accolés les uns aux autres. Ces plans parallèles sont faiblement liés les uns aux autres, ce qui explique la texture friable.
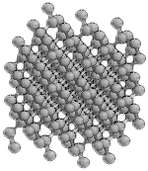
diamant graphite
Récemment, nous pensions encore qu'il n'existait que ces deux formes de carbone à l'état pur, jusqu'à la découverte des fullerènes...
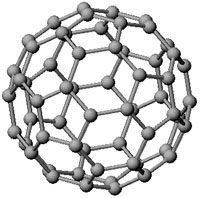
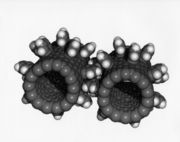
Les joueurs de football de l'euro 2008 ne le savent peut-être pas, mais le ballon dans lequel ils tapent actuellement est ce qu’on appelle en géométrie un icosaèdre tronqué. Cette forme bien particulière est un assemblage d’hexagones et de pentagones arrangés de manière sphérique. Ce que l’on nomme à tort le "ballon rond" possède en fait 32 faces, réparties entre 20 hexagones et 12 pentagones.
C’est un très bon compromis entre aérodynamisme, grâce à l’aspect sphérique, et réactivité, notamment pour appliquer des effets et contourner par exemple un mur. Mais quand les Anglais ont créé le ballon sous sa forme moderne, à la fin du XIXe siècle, ils ne se doutaient pas que la Nature connaissait l’icosaèdre tronqué depuis toujours ! Il existe en effet une molécule qui possède exactement la même forme caractéristique, dont la formule chimique est C60. Composée uniquement d’atomes de carbone, cette molécule a été découverte il y a vingt ans à peine, et par le plus grand des hasards... À la fin des années 70, les scientifiques Robert Curl, Harold Kroto et Richard Smalley ont observé dans les nuages froids interstellaires une famille quasi-inconnue de molécules, appelées cyanopolyynes ; quelques années plus tard, ils ont émis l’hypothèse qu’elles étaient fabriquées par les "étoiles à carbone", les géantes rouges. Voulant percer le secret de leur fabrication, ils ont tenté de reproduire les conditions qui règnent au sein de telles étoiles. Mais au lieu de créer les molécules recherchées, ils ont obtenu, en 1985, du C60 ! Ils ont très vite émis l’hypothèse que cette molécule avait la forme d’un ballon de football, en 10 millions de fois plus petit !
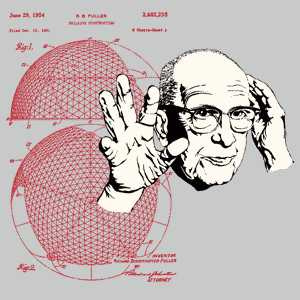
Chose confirmée par d’autres scientifiques en 1990. Ce qui est encore plus étonnant, c’est qu’après avoir cherché à comprendre d’où venaient ces molécules, on a découvert qu’il suffisait d’allumer une bougie pour en obtenir en abondance ! Le C60 fait partie de la famille des fullerènes, baptisés ainsi en l’honneur de Buckminster Fuller (le C60 est d’ailleurs appelé le buckminsterfullerène), l’architecte qui a créé le dôme géodésique pour l’exposition universelle de Montréal en 1967 ainsi que l'atomium de Bruxelles. On les appelle aussi - évidemment ! - les footballènes.

dôme géodésique de Montréal Buckminster Fuller
atomium de BruxellesCette famille de molécules compte de nombreux représentants, parmi lesquels le C20, le C70, le C540… Ce dernier est bien moins rond !
Toutes ne se trouvent pas dans la Nature, mais elles sont chacune étudiées de près par les scientifiques. Les fullerènes, qui sont donc la troisième forme connue de carbone pur, après le diamant et le graphite, sont semble-t-il promis à un bel avenir.
Ces structures fantastiques stimulent l'imagination des chimistes. Ainsi l'on pense arriver à fabriquer au cours du prochain siècle de véritables machines moléculaires en utilisant des engrenages à base de fullérènes !
Références utilisées :
Wikipedia
Université de Strasbourg
Banque des savoirs