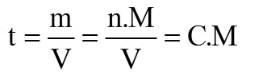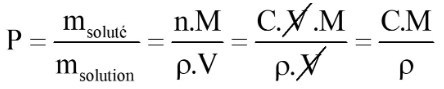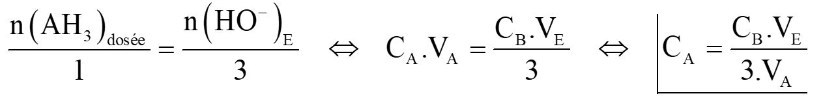1. Choisir le solvant le plus adapté pour extraire l'eugénol d'une phase aqueuse.
On dispose de 60mL de ce solvant.
Rédiger le protocole de l'extraction.
Faire un schéma légendé de l'ampoule à décanter une fois l'extraction réalisée.
Données :

Propriétés d'un bon solvant d'extraction :
- il ne doit pas être soluble dans l'eau (où l'eugénol est présent) : ce qui élimine l'éthanol.
- l'espèce à extraire (eugénol) doit y être très soluble : cyclohexane et tétrachlorométhane ont cette propriété.
- il doit être le moins toxique possible : la toxicité du cyclohexane est plus faible que celle du tétrachlorométhane.
Le solvant d'extraction retenu est donc le cyclohexane.
Protocole d'extraction :
- introduire la phase aqueuse dans l'ampoule à décanter.
- introduire 60mL de cyclohexane.
- boucher l'ampoule à décanter.
- agiter en orientant le bec de l'ampoule à décanter vers un endroit dégagé et en dégazant régulièrement.
- reposer l'ampoule à décanter sur son support et laisser décanter.
- enlever le bouchon et récupérer la phase supérieure organique (cyclohexane + eugénol)
Positions des phases : comparer les densité des solvants
d (cyclohexane) < d(eau) donc la phase organique de cyclohexane est la phase supérieure.
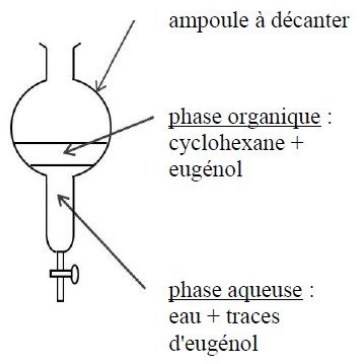
Remarque : une extraction n'est jamais totale !
La quantité d'eugénol qui a été extraite dans le cyclohexane peut se calculer ainsi :
quantité extraite =
quantité initiale phase aqueuse - quantité finale phase aqueuse
La technique en vidéo !
Retour aux questions !
|
2. Citer trois techniques d'analyse d'une espèce chimique synthétisée.
① Mesurer la température de fusion (avec un banc Kofler) ou d'ébullition (lors de la distillation) pour la comparer avec la valeur de référence.
② Effectuer une Chromatographie sur Couche Mince du produit brut en déposant aussi sur la plaque CCM l'espèce chimique d'intérêt attendue et les réactifs utilisés lors de la synthèse.
③ Faire un spectre infra-rouge de l'espèce synthétisée.
Retour aux questions !
|
3. Comment augmenter la vitesse d'une transformation chimique ?
Pour augmenter la vitesse de formation d'un produit, on peut :
- chauffer le milieu réactionnel avec un montage de chauffage à reflux,
- utiliser un catalyseur,
- augmenter la concentration des réactifs en solution.
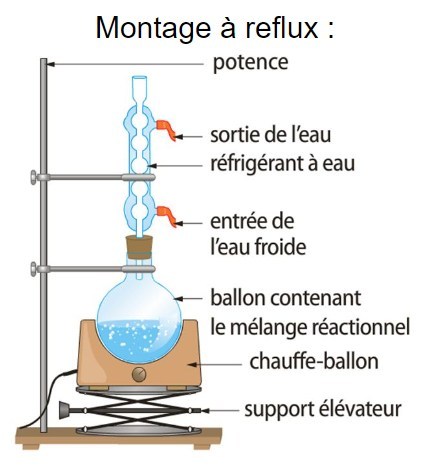
Montage à reflux : principe et explications
Retour aux questions !
|
4. Comment augmenter le rendement d'une transformation chimique ?
Dans le cas où une réaction opposée limite une synthèse (réaction non totale),
on peut améliorer le rendement de cette dernière :
- en introduisant l'un des réactifs en excès (le moins coûteux),
- en éliminant du milieu réactionnel un des produits de la réaction.
L'équilibre est alors déplacé dans le sens direct ce qui augmente le rendement.
Retour aux questions !
|
5. Comment choisir la verrerie à utiliser pour mesurer des volumes en exploitant les précisions des volumes données dans le protocole ?
Exemple : Dans un bécher,
- introduire 25mL d'eau,
- 10,0mL de solution A,
- et 30mL de solution B.
Indiquer la verrerie à utiliser pour chacun de ces prélèvements.
- 25mL d'eau : mesure au mL donc éprouvette graduée de 25mL
- 10,0mL de solution A: mesure au 0,1mL donc pipette jaugée de 10,0mL
- 30mL de solution B : mesure au mL donc éprouvette graduée de 50mL
Si le volume concerne une espèce à doser, il doit être mesuré avec beaucoup de précision : pipette jaugée.
Lors des dilutions, il faut utiliser systématiquement de la verrerie jaugée : pipette et fiole jaugées.
Rappel : on n'utilise pas les graduations des béchers ou des erlenmeyers pour faire des mesures de volume.
Retour aux questions !
|
6. Comment choisir un indicateur coloré adapté à ce titrage ?
Données :
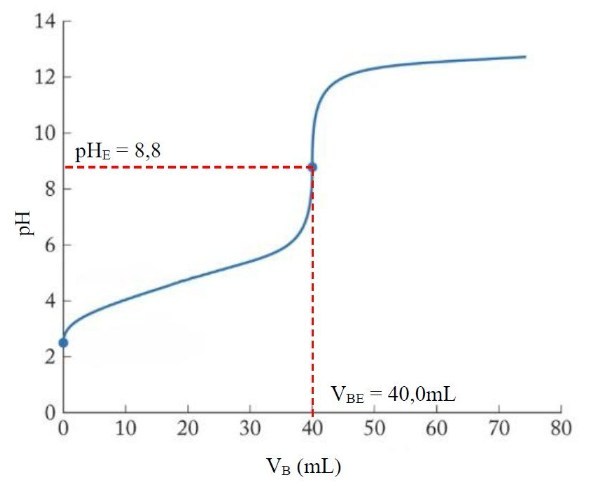

La zone de virage de l'indicateur coloré doit contenir le pH à l'équivalence.
Ici le pH à l'équivalence vaut 8,8.
Il faut donc choisir la phénolphtaléïne car : 8,2 < pHE < 9,9
L'indicateur coloré virera de l'incolore au rose à l'équivalence de ce titrage.
Retour aux questions !
|
7. Comment effectuer une filtration sous vide ?
La réponse en vidéo !
Retour aux questions !
|
8. Comment exploiter un titrage avec suivi conductimétrique avec le logiciel LatisPro ?
La réponse en vidéo !
Entraînez-vous sur avec ce fichier LatisPro disponible sur scphysiques.
Retour aux questions !
|
9. Comment exploiter un titrage avec suivi pHmétrique avec le logiciel LatisPro ?
La réponse en vidéo !
Entraînez-vous sur avec ce fichier LatisPro disponible sur scphysiques.
Retour aux questions !
|
10. Comment mesurer la température de fusion d'un solide avec un banc Kofler ?
La technique en vidéo !
Retour aux questions !
|
11. Comment mettre en œuvre la méthode des tangentes parallèles pour déterminer les coordonnées du point équivalent lors d'un titrage pHmétrique (sans ordinateur) ?
La méthode en vidéo !
Retour aux questions !
|
12. Comment réaliser une extraction liquide-liquide ?
La réponse en vidéo !
Retour aux questions !
|
13. Comment s'appelle cette verrerie ?
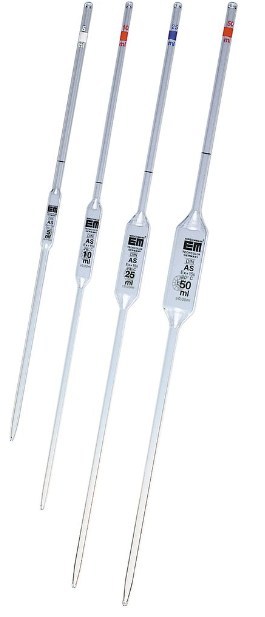
Ce sont des pipettes jaugées (1 trait).
Comment utiliser une pipette jaugée ?
Retour aux questions !
|
14. Comment s'appelle cette verrerie et comment la mettre en service avec une solution ?
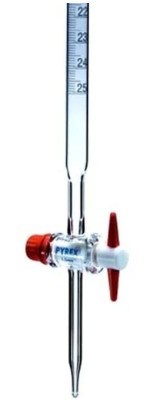
C'est une burette graduée utilisée pour verser le réactif titrant lors d'un dosage.
- ouvrir le robinet et mettre le flacon poubelle sous la burette,
- rincer les parois de la burette avec un peu de solution titrante et attendre l'écoulement total de la solution,
- fermer le robinet et remplir la burette graduée avec la solution titrante en dépassant largement le zéro,
- chasser l'air dans le bec de la burette (partie sous le robinet) en ouvrant à fond le robinet,
- ajuster le niveau de solution au zéro de la burette (bas du ménisque au niveau du zéro).
Comment réaliser un titrage (colorimétrique) ?
Retour aux questions !
|
15. Le pH d'une solution d'acide éthanoïque CH3CO2H et d'ions éthanoate CH3CO2- est égal à 6,4.
Indiquer quelle est l'espèce qui prédomine dans cette solution.
Donnée : pKA (CH3CO2H/CH3CO2-) = 4,8
D'après le diagramme de prédominance :
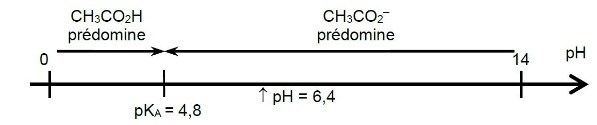
comme pH > pKA, c'est la base du couple CH3CO2- qui prédomine.
Retour aux questions !
|
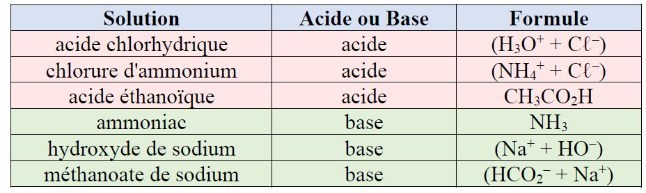
16. Le pH d'une solution inconnue a été mesuré : il vaut 2,3.
Quelles solutions peut-on exclure parmi celles données dans le tableau ci-après ?
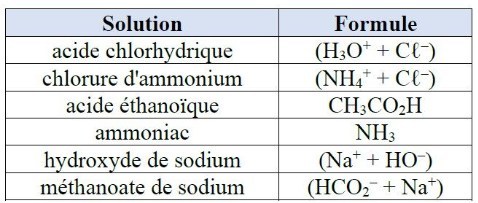
Le pH mesuré est inférieur à 7 : la solution est acide.
Il s'agit donc d'un acide. Les trois dernières espèces du tableau sont des bases : on peut donc les exclure.
Retour aux questions !
|
17. Les calculs d'une concentration ont conduit à :
C = 0,1555mol.L–1
u(C) = 0,0285mol.L–1
Comment présenter le résultat de cette mesure assorti de son incertitude de mesure ?
Présentation d'un résultat : ne garder qu'un seul chiffre pour l'incertitude et la majorer (arrondir au-dessus). Le dernier chiffre significatif conservé pour la valeur mesurée est celui sur lequel porte l'incertitude.
Si le calcul d'incertitude donne
u(C) = 0,0285mol.L–1
il ne faut ne garder qu'1CS pour u(C) en majorant :
u(C) =0,03mol.L–1
L'incertitude porte sur le deuxième chiffre après la virgule donc on arrondit à la valeur la plus proche pour C en ne gardant que deux chiffres après la virgule.
C = 0,16 ±0,03mol.L–1
soit un intervalle de confiance
[0,013mol.L–1; 0,019mol.L–1]
Retour aux questions !
|
18. Lors d'une électrolyse, on souhaite déposer du cuivre sur une électrode en graphite.
Comment mesurer expérimentalement la masse de cuivre qui s'est déposée lors de l'électrolyse ?
Il suffit de mesure la masse initiale de l'électrode ainsi que sa masse finale et de faire la différence :
mdépot = mfinale - minitiale
Pour mesurer la masse finale, quelques précautions à prendre :
- rincer l'électrode à l'eau distillée pour éliminer la solution du bain d'électrolyse,
- puis la sécher (en utilisant un séche-cheveux par exemple) afin de ne pas fausser la mesure avec l'eau présente sur l'électrode.
Retour aux questions !
|
19. Lors d'une électrolyse, on souhaite déposer du cuivre sur une électrode en graphite.
Comment mesurer expérimentalement la masse de cuivre qui s'est déposée lors de l'électrolyse ?
Il suffit de mesure la masse initiale de l'électrode ainsi que sa masse finale et de faire la différence :
mdépot = mfinale - minitiale
Pour mesurer la masse finale, quelques précautions à prendre :
- rincer l'électrode à l'eau distillée pour éliminer la solution du bain d'électrolyse,
- puis la sécher (en utilisant un séche-cheveux par exemple) afin de ne pas fausser la mesure avec l'eau présente sur l'électrode.
Retour aux questions !
|
20. On souhaite diluer 20 fois une solution mère de concentration CM = 0,20mol.L-1
Indiquer le protocole de cette dilution.
Quelle sera la concentration de la solution fille ?
Matériel disponible :
- éprouvette graduées de 5, 20, 50 et 100mL
- fioles jaugées de 20,0 et 100,0mL
- pipette jaugées de 5,0 et 10,0mL
- béchers de 100mL et pipeteur
Il faut utiliser de la verrerie jaugée en priorité car c'est la verrerie la plus précise.
La fiole jaugée à utiliser (pour réaliser la solution fille) est celle de 100mL car combinée avec la pipette jaugée de 5,0mL (pour prélever la solution mère) elle permet d'obtenir le facteur de dilution souhaité.
F = 20 = CM / CF = VF / VM
On a bien : 100mL / 5,0mL = 20 = F
Remarque : avec la fiole jaugée de 20mL il faudrait prendre une pipette jaugée de 1,0mL qui ne figure pas dans la liste de matériel.
Protocole :
① Prélever 5,0mL de solution mère avec une pipette jaugée de 5,0mL.
② Les introduire dans une fiole jaugée de 100mL.
③ Ajouter de l'eau distillée aux 2/3.
④ Ajouter de l'eau distillée jusqu'au trait de jauge. Agiter
F = 20
Donc la concentration de la solution fille est 20 fois plus petite :
CF = CM / 20 = 0,20 / 20 = 0,010mol.L-1
La technique en vidéo !
Retour aux questions !
|
21. On souhaite préparer V = 200mL d'une solution de chlorure de sodium de concentration en masse :
t = 15g.L-1
Indiquer le protocole de cette dissolution.
Matériel disponible :
- capsule de pesée
- balance au 1/100 de g
- éprouvette graduées de 50, 100 et 200mL
- fioles jaugées de 20,0, 100,0 et 200,0mL
- béchers de 100mL
Masse de chlorure de sodium à peser :
m = t.V = 15x0,200 = 3,0g
Protocole dissolution :
① Peser 3,0g de NaCℓ dans une capsule de pesée.
② Les introduire dans une fiole jaugée de 200mL.
Rincer la capsule en récupérant l'eau de rinçage dans la fiole jaugée.
③ Ajouter de l'eau distillée aux 2/3. Agiter jusqu'à dissolution des cristaux.
④ Ajouter de l'eau distillée jusqu'au trait de jauge. Agiter.
Retour aux questions !
|
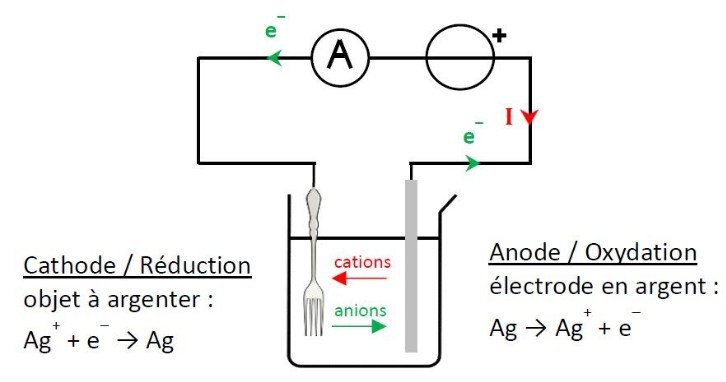
22. Pour argenter des objets métalliques, les orfèvres utilisent le principe de l'électrolyse à "anode soluble" dans un bain contenant des ions argents Ag+.
Une électrode est constituée de l'objet à argenter, l'autre est une électrode d'argent qui permettra de fournir des ions argent au bain d'électrolyse.
Schématiser le montage expérimental en précisant les bornes du générateur auxquelles sont reliées l'objet à argenter et l'électrode d'argent.
Données :
couple oxydant réducteur : Ag+ / Ag
Le dépôt d'argent est réalisé par la réaction de réduction suivante :
Ag+ + e- → Ag
C'est une réaction de réduction qui se produit à la cathode (reliée à la borne moins du générateur).
Retour aux questions !
|
23. Proposer un protocole pour réaliser un dosage par étalonnage colorimètrique (les solutions étalons étant fournies).
① Choisir la longueur d'onde de travail sur le colorimètre : longueur d'onde qui correspond au maximum d'absorption de l'espèce étudiée.
② Faire le blanc du colorimètre à cette longueur d'onde : régler l'absorbance à zéro avec une cuve remplie avec le solvant (de l'eau distillée en général).
③ Mesurer l'absorbance des solutions étalons ainsi que celle de la solution inconnue.
④ Tracer la courbe d'étalonnage A = f(C) en utilisant LatisPro puis la modéliser par une fonction linéaire (pour tester la loi de Beer-Lambert A = k.C).
⑤ Reporter graphiquement l'absorbance de la solution inconnue sur la courbe pour en déduire sa concentration.
Remarques :
- il peut être nécessaire de diluer la solution inconnue pour la ramener dans la gamme d'étalonnage disponible.
- la cuve doit être remplie jusqu'à environ 0,5cm du rebord et elle doit être rebouchée.
- prendre la cuve en mettant les doigts sur les faces striées.
- attention au positionnement de la cuve dans le colorimètre : le faisceau doit traverser les faces transparentes et non pas les faces striées.
- ne pas oublier de mettre le cache lors des mesures.
Retour aux questions !
|
24. Proposer un protocole pour réaliser un dosage par étalonnage conductimétrique (les solutions étalons étant fournies).
① Étalonner le conductimètre avec la solution de conductivité connue fournie.
② Mesurer la conductivité des solutions étalons ainsi que celle de la solution
inconnue.
③ Tracer la courbe d'étalonnage σ = f(C) en utilisant LatisPro puis la modéliser
par une fonction linéaire (pour tester la loi de Kohlrausch σ = k.C).
④ Reporter graphiquement la conductivité de la solution inconnue sur la
courbe pour en déduire sa concentration.
Remarque :
Penser à rincer la sonde du conductimètre avec de l'eau distillée entre deux mesures.
Il peut être nécessaire de diluer la solution inconnue pour la ramener dans la gamme d'étalonnage disponible.
Retour aux questions !
|
25. Qu'est-ce qu'une extraction liquide-liquide et comment la réaliser ?
Une extraction est une opération qui consiste à extraire une espèce chimique du milieu qui le contient.
Pour une espèce chimique dissoute dans un liquide (appelé solvant), on peut utiliser un autre liquide, appelé solvant d’extraction.
Il s’agit d’une extraction liquide-liquide.
Le solvant d’extraction doit vérifier trois conditions pour être utilisé :
① l’espèce chimique à extraire est plus soluble dans le solvant d’extraction que dans le solvant de départ ;
② le solvant d’extraction n’est pas miscible au solvant de départ ;
③ le solvant doit être celui qui présente le moins de risques possibles.


Retour aux questions !
|
26. Quel est le protocole à mettre en oeuvre pour effectuer une CCM (chromatographie sur couche mince) ?
① Introduire l'éluant jusqu'à une hauteur d'environ 0,5 cm dans la cuve à
chromatographie, puis la fermer. Les vapeurs d'éluant vont alors
saturer la cuve.
② Dissoudre ou diluer les composés à analyser dans l'éluant ou un solvant approprié, par exemple :
- le réactif limitant utilisé lors de la synthèse
- l'espèce attendue
- le produit obtenu après la synthèse
③ Préparation de la plaque : à environ 1 cm du bas de la plaque, tracer délicatement, sans appuyer, une ligne au crayon à papier. Indiquer sur cette ligne les positions des dépôts que vous allez effectuer puis effectuer ces dépôts souhaités à l'aide de piques (changer de pique pour les différents dépôts).
④ Placer verticalement la plaque dans la cuve, et la refermer rapidement. Au départ, l'éluant ne doit pas toucher les dépôts.
⑤ SANS BOUGER LA CUVE, attendre que l'éluant soit arrivé à environ 1 cm du bord supérieur.
⑥ Retirer la plaque et tracer rapidement au crayon à papier un trait indiquant la hauteur atteinte par l'éluant.
⑦ Réveler la plaque à la lampe UV (entourer les taches) ou en pulvérisant le réactif approprié.
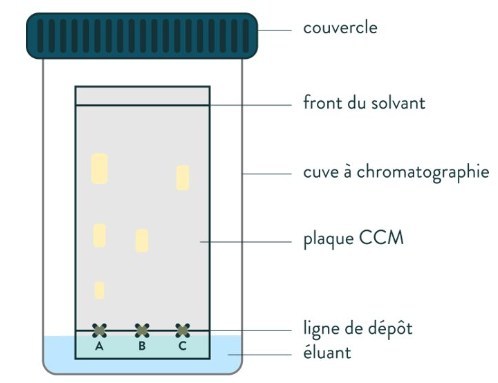
La technique en vidéo !
Retour aux questions !
|
27. Quelle est la relation entre :
- la concentration massique t (en g.L-1)
- et la concentration en quantité de matière (en mol.L-1) ?
t = C.M
en effet :
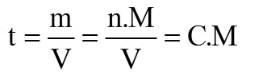
avec M (masse molaire) en g.mol-1
Retour aux questions !
|
28. Quelle est la relation entre :
- le pourcentage massique P (ou titre massique),
- et la concentration en quantité de matière C (en mol.L-1) ?
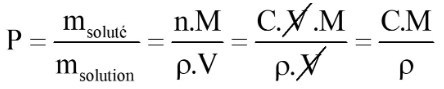
avec :
- ρ la masse volumique de la solution (g.L-1)
- et M la masse molaire (g.mol-1)
Attention à bien exprimer ρ en g.L-1 pour avoir un système d'unité cohérent !
Retour aux questions !
|
29. Quelle est la verrerie la plus précise ?
Il s'agit de la verrerie jaugée (pipettes jaugées et fioles jaugées) utilisées :
- pour préparer des solutions (dilution ou dissolution)
- et pour prélever l'espèce titrée lors d'un dosage.
Retour aux questions !
|
30. Schématiser le titrage de VA = 20,0mL d'une solution SA d'acide citrique AH3 par une solution d'hydroxyde de sodium (Na++HO-) de concentration CB = 0,10mol.L-1 avec suivi pHmétrique.
Indiquer commment déterminer le volume équivalent puis comment l'exploiter pour calculer la concentration CA en acide citrique.
Équation de la réaction :
AH3(aq) + 3HO– (aq) → A3−(aq) + 3H2O(ℓ)
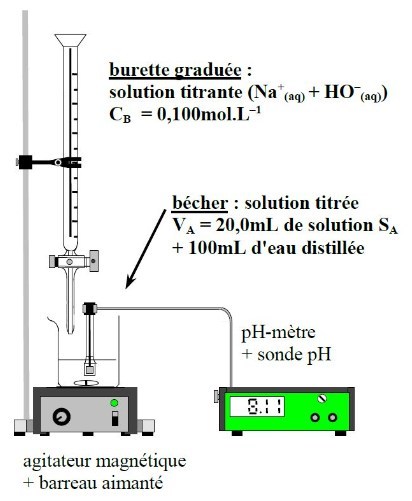
L'ajout de 100mL d'eau distillée permet d'avoir un volume de solution suffisant pour pouvoir immerger la sonde pH : ce volume ne modifie pas la quantité de matière d'acide titré ni le volume équivalent. Sa mesure n'a pas besoin d'être précise : utilisation d'une éprouvette graduée.
Faire des ajouts 1mL par 1mL puis resserrer les ajouts (tous les 0,5mL) au niveau du saut de pH.
Le volume équivalent VE est repéré par la méthode des tangentes parallèles ou bien en repérant l'abscisse de l'extremum de la courbe dérivée.
Équation de la réaction :
AH3(aq) + 3HO– (aq) → A3−(aq) + 3H2O(ℓ)
À l'équivalence, les réactifs ont été introduits dans les proportions stœchiométriques :
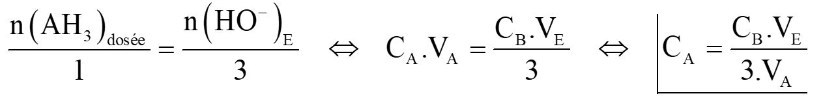
Retour aux questions !
|
31. Une solution aqueuse en chlorure de sodium a une masse volumique égale à : ρ = 1008g.L-1
Quelle est sa concentration massique t ?
Donnée : Courbe d'étalonnage
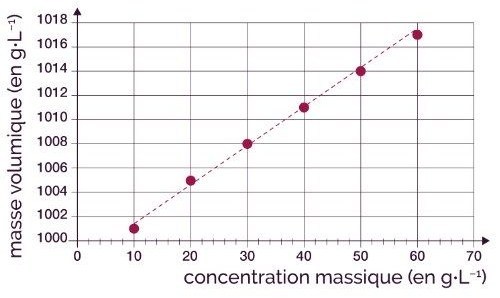
Par lecture graphique, pour ρ = 1008g.L-1
on lit : t = 30g.L-1
Ne pas confondre la masse volumique ρ
avec la concentration en masse t !
ρ = masse de la solution / volume de la solution
t = masse de soluté / volume de la solution
Retour aux questions !
|